A Leucemia Linfoide Aguda (LLA)
Segundo hospital Boldrini
A leucemia é o câncer mais comum nas crianças e adolescentes. É o câncer que acomete as células do sangue,
os glóbulos brancos, daí o nome de leucemia, que vem do grego “leukós”, cjo significado é “branco”. Existem duas famílias principais de glóbulos brancos,
a família linfoide e a mieloide. A leucemia acomete tanto a família de células linfoides quanto a mieloide.
A leucemia linfoide aguda é o câncer mais comuns e correspondem a praticamente um quarto de todos os casos de câncer em crianças e adolescentes. No Brasil,
estima-se que são 3000 casos novos de leucemia linfoide aguda pediátrica por ano. Origina-se a partir de linfócitos jovens, que se multiplica sem parar e
dessa forma acabam atrapalhando a organização e produção das demais células do sangue, levando a deficiências de plaquetas, glóbulos vermelhos e das demais
células de defesa, o que pode ocasionar problemas de sangramentos e infecções, por exemplo
As células
Segundo hospital Boldrini
A família de células linfoides é formada pelos linfócitos, e são células encarregadas da imunidade adaptativa,
ou seja, são células capazes de “aprender” a reconhecer os vírus, bactérias e mesmos substancias químicas estranhas ao organismo, criando defesa contra as mesmas
através da produção de anticorpos ou pelo reconhecimento e eliminação das células infectadas. A família de células mieloides é mais variada.
A ela pertencem, por exemplo, os eritrócitos, que dão origem aos glóbulos vermelhos, responsáveis pela oxigenação do organismo. Também fazem parte desta
família os megacariócitos, que produzem as plaquetas, importantes para a cicatrização das feridas. E finalmente, diferentes tipos de células, entre os quais os
monócitos, basófilos, neutrófilos e macrófagos, que são responsáveis pela imunidade inata, que assim como os linfócitos atuam na defesa do organismo.
O tratamento
Segundo hospital Boldrini
O tratamento da leucemia linfoide aguda alcança índices de cura superiores a 80%. O tratamento demora
2 a 3 anos e consiste em uma fase inicial de 1 mês, para a Indução da remissão, ou seja, para eliminar todas as células leucêmicas.
Esta fase inicial é seguida de um período de 3 a 6 meses para a Consolidação da remissão, e finalmente por um período de 2 anos para a Manutenção da remissão.
O tratamento é feito com uso de diferentes fármacos, chamados de quimioterápicos, entre os quais os mais comuns são a Prednisolona, vincristina, asparaginase,
metotrexato, mercaptopurina, ciclofosfamida, daunorrubicina. O resultado do tratamento é monitorado em cada uma das fases, pela análise da medula óssea,
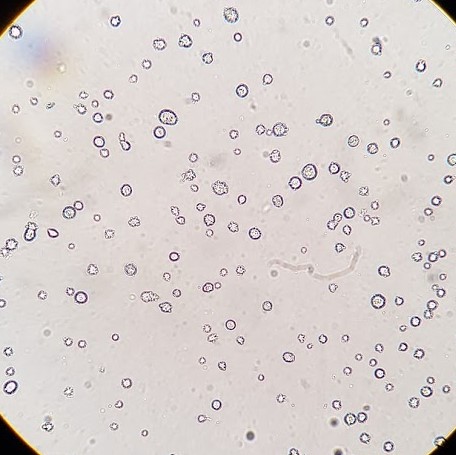
que corresponde ao tutano que existe no interior dos ossos e é onde se dá a produção das células do sangue.
O reaparecimento das diferentes famílias de células que compõe o sangue é avaliado por análise ao microscópio e a presença de células leucêmicas residuais é
quantificada por análises mais sofisticadas, por exemplo através de sequenciamento do DNA. Havendo presença de células leucêmicas residuais, o paciente é
submetido a tratamento mais intenso, ao passo que a ausência de células residuais permite em alguns casos a redução da intensidade do tratamento e consequentemente
redução do risco de efeitos colaterais causados pela quimioterapia.
Avanços no combate a doença
Segundo hospital Boldrini
O recente desenvolvimento de técnicas de análise genética tem permitido identificar quais os genes que foram mutados
na origem da leucemia. Essa informação tem permitido classificar as leucemias em diferentes subgrupos genéticos, os quais, em alguns casos, beneficiam-se de tratamentos
específicos. Por exemplo, leucemias com a mutação BCR-ABL1, que antigamente eram de alto risco de recaída, hoje beneficiam-se do uso de um quimioterápico novo, chamado
imatinib. Além destes avanços na área da genética e desenho de drogas contra alvos específicos da célula tumoral, tem havido também grande avanço na área de imunoterapia.
Alguns casos de leucemia linfoide aguda podem ser tratados com uso de anticorpos que reconhecem a célula leucêmica, ou ainda pela engenharia genética das células de defesa,
de modo a que estas se encarreguem de encontrar e eliminar as células leucêmicas, da mesma forma que fariam se fosse uma célula infectada com vírus.
Os microdispositivos
O desenvolvimento da LLA e as respostas individuais ao tratamento são influenciados diretamente pelo microambiente tumoral da medula óssea (MO). Este microambiente é composto por matriz extracelular, células e fluido intersticial, que desempenha papel importante na atividade tumoral. Os estudos pré-clínicos de drogas, entretanto, são realizados em modelos experimentais bi e tridimensionais que não refletem a complexidade estrutural e o caráter dinâmico de escoamento de fluidos existente na MO. Além disso, os ensaios realizados nestes modelos são onerosos. Estas limitações impactam diretamente os resultados obtidos e comprometem o estabelecimento de estratégias terapêuticas eficazes.
Neste cenário, os dispositivos microfluídicos (DMs) aparecem como uma tecnologia promissora. Os DMs são sistemas miniaturizados, com canais cujas dimensões são micrométricas, e que permitem a passagem de pequenas quantidades de fluídos. Requerem menores quantidades de amostra e reagentes e permitem análises biológicas e bioquímicas de modo mais célere. Podem ser combinados em plataformas e projetados para mimetização de microambientes biológicos (Young, 2013). Apesar das vantagens apresentadas, limitações técnicas dos dispositivos descritos na literatura até o momento para mimetização do microambiente tumoral da LLA comprometem a sua aplicação como plataforma de teste de drogas e análises de fatores individuais relacionados à resistência aos fármacos. Verifica-se, deste modo, o potencial ainda não explorado desta tecnologia para contribuir com avanços no tratamento das crianças com LLA.